Endometriose ist eine chronisch-entzündliche Erkrankung, die durch das Vorkommen von Gebärmutterschleimhaut (Endometrium)-ähnlichem Gewebe außerhalb der Gebärmutter (Uterus) oder innerhalb der Gebärmuttermuskulatur (Myometrium) charakterisiert ist. Dieses Gewebe bildet sogenannte Endometriose-Herde aus Drüsen, Stromazellen und glatter Muskulatur, die von Nerven, Lymph- und Blutgefäßen versorgt werden.
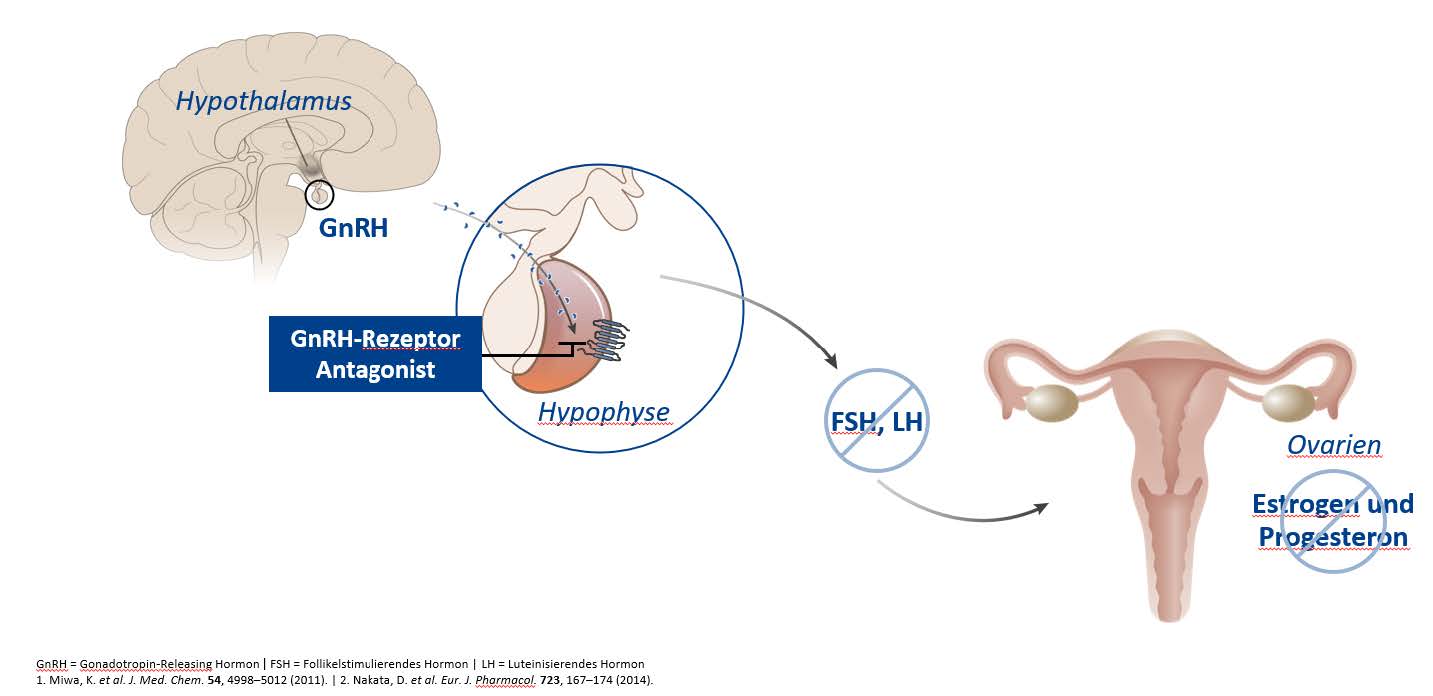
Dabei unterliegen die Endometriose-Zellen, wie auch das physiologische Endometriumgewebe selbst, dem hormonellen Zyklus. Aufgrund dieser Hormonabhängigkeit begleitet die Endometriose – ähnlich wie bei Gebärmuttermyomen – betroffene Patientinnen meist während ihrer gesamten reproduktiven Phase und bessert sich ohne entsprechende Therapie erst wieder nach Eintreten der Menopause. Insbesondere Östrogene (auch Estrogene genannt) aber auch Progesteron spielen bei Endometriose eine entscheidende Rolle und werden unter anderem durch ein im Gehirn (Hypothalamus) gebildetes Hormon namens Gonadotropin-Releasing-Hormon (GnRH) reguliert (Abbildung 1).
Die Relugolix-Kombinationstherapie (RYEQO®) nutzt diese Eigenschaft für die Behandlung mäßiger bis starker Symptome von Gebärmuttermyomen und der symptomatischen Behandlung der Endometriose bei Frauen mit vorausgegangener medikamentöser oder chirurgischer Behandlung ihrer Endometriose. Denn dieses Medikament enthält 40 mg des Wirkstoffs Relugolix, der zur Gruppe der oral verfügbaren, nicht-peptidischen GnRH-Antagonisten gehört und GnRH-Rezeptoren im Gehirn (Hypophysenvorderlappen) reversibel blockiert (Abbildung 1). Dadurch wird die Freisetzung des Follikelstimulierenden Hormons (FSH) und Luteinisierenden Hormons (LH) reduziert (Abbildung 1). Die Verringerung der FSH-Konzentration verhindert das Follikelwachstum und die Follikelentwicklung und setzt dadurch die Bildung des Hormons Estradiol (E2, ein Östrogen) in den Eierstöcken (Ovarien) herab (Abbildung 1). Durch die Verhinderung eines LH-Anstiegs werden der Eisprung (Ovulation) und die Entwicklung des Gelbkörpers (Corpus luteum) gehemmt, wodurch die Bildung von Progesteron verhindert wird (Abbildung 1).
Um diesen therapeutischen Bereich zu erreichen, befinden sich in einer Filmtablette RYEQO® zusätzlich zum Wirkstoff Relugolix noch 1 mg bioidentisches Estradiol (E2) und 0,5 mg Norethisteronacetat (NETA). Bei Estradiol handelt es sich um dasselbe Hormon, das auch endogen, also vom eigenen Körper, gebildet wird und Symptome im Zusammenhang mit einem Estrogenmangel, beispielsweise vasomotorische Symptome wie Hitzewallungen und Knochendichteverlust reduzieren kann. Norethisteronacetat ist ein synthetisches Gestagen, das einer estrogeninduzierten Verdickung der Gebärmutterschleimhaut (Endometrium) entgegenwirkt und diese dadurch schützt.
In den klinischen Phase-3-Studien mit RYEQO® lagen die medianen Estradiol-Vordosiskonzentrationen nach 24 Wochen bei Patientinnen mit Uterusmyomen bei ca. 33 pg/ml und bei Patientinnen mit Endometriose bei ca. 38 pg/ml, entsprechend den Estradiolkonzentrationen, die mit der frühen Follikelphase des Menstruationszyklus assoziiert werden. Damit lagen die Estradiolkonzentrationen im therapeutischen Bereich. Die Progesteronspiegel in beiden Gruppen wurden mit RYEQO® auf einem Niveau von < 3,0 ng/ml gehalten.